INFERTILIDAD
ESTUDIOS EN LA PAREJA
Desde OMICASLAB, ofrecemos estudios tanto para el hombre como para la mujer enfocados a los distintos trastornos que presente la pareja.
PARA LA MUJER
-
Falla de implante ESTUDIO ENDOMIC
ESTUDIO ENDOMIC
ANÁLISIS INTEGRADO DE LA FALLA DE IMPLANTACIÓN EMBRIONARIA
En un ciclo de Fecundación In Vitro (FIV), la tasa de embarazo se sitúa en torno al 60%. Es ampliamente aceptado que esto depende de un adecuado intercambio de señales entre el embrión y el endometrio En ocasiones, aún contando con embriones de calidad óptima, no es posible lograr una implantación exitosa, debido a factores que impiden la nidación.
Se definen como fallos de implantación embrionaria a aquellos casos en los que se ha realizado una transferencia de 4 a 6 embriones de calidad adecuada, en 2 o 3 procedimientos de FIV, sin lograr embarazo.
El protocolo ENDOMIC es un estudio multifactorial que aborda las causas probables de la Falla de Implantación Embrionaria analizándolas con una visión integral que complementa la conducta clínica frente a la patología.
ENDOMIC 1 ESTUDIO DEL FACTOR INFECTOLÓGICO
Fundamentos del estudio
Actualmente, se estima que la infertilidad afecta aproximadamente a un 15% de las parejas de todo el mundo. En general, los problemas de fertilidad se deben a una causa relacionada con la salud reproductiva de la mujer o la calidad espermática del hombre, para las cuales existen diferentes tratamientos. Sin embargo, aunque los métodos de diagnóstico de infertilidad han mejorado notablemente en los últimos años, existe entre un 15-30% de parejas en todo el mundo que desconocen cuál es el origen de su infertilidad. Hablamos en este caso de infertilidad idiopática, inexplicada o sin causa aparente, debido a que no es posible determinar cuál es el origen de este problema reproductivo.
A pesar de que las causas de infertilidad idiopática se han relacionado con diversos problemas de carácter endocrino, genético o fisiológico, numerosos estudios sugieren que gran parte de estos problemas reproductivos se deben a un factor infectológico. De todas las causas de infertilidad, justamente las infecciones del tracto genital constituyen el 30-40% de los casos. Existen una gran variedad de microorganismos que pueden colonizar el tracto reproductivo femenino y masculino y desencadenar procesos infecciosos, acompañados muchas veces de respuestas inflamatorias con múltiples consecuencias adversas. Este tipo de infecciones se caracterizan por ser comunes y en la gran mayoría de los casos, asintomáticas, por lo que son imperceptibles por parte de los pacientes. Esta falta de sintomatología evita que las infecciones sean tratadas, y en consecuencia, puedan causar daños crónicos que conduzcan a problemas en la fertilidad. En este aspecto, es importante destacar también las enfermedades de transmisión sexual, provocadas también por la colonización de distintos tipos de microorganismos en el tracto reproductivo y que, si no reciben tratamiento, pueden provocar problemas a largo plazo, incluida la enfermedad inflamatoria pélvica e infertilidad.
Por todo ello, el estudio de la presencia de agentes infecciosos se ha convertido en una estrategia indispensable para determinar si, en casos complejos de infertilidad idiopática, existe un factor infectológico causante de los problemas de infertilidad que esté impidiendo la correcta consecución del embarazo. Con la realización de un estudio exhaustivo de nuestro panel de detección de microorganismos patógenos, se busca identificar estas infecciones y combatirlas previamente a los métodos de fertilidad a los que vayan a ser sometidos los pacientes, con el fin de que no puedan interferir de forma negativa al correcto desarrollo del embarazo.
Metodología
Partiendo de muestras de exudado endocervical, exudado uretral, semen o primera fracción miccional, y mediante el uso de técnicas de qPCR y PCR convencional, esta prueba nos permite detectar los agentes patógenos más comunes causantes de infecciones en el sistema reproductor femenino y masculino. Estos agentes son:
- Chlamydia trachomatis
- Mycoplasma hominis
- Ureaplasma urealyticum
- Virus Herpes simplex (HSV-1, HSV-2)
- Virus del papiloma humano (HPV)
- Herpesvirus 6 de tipo A (HHV-6A)
ENDOMIC 2 TRANSCRIPTÓMICA EN VENTANA DE IMPLANTE
Fundamentos del estudio
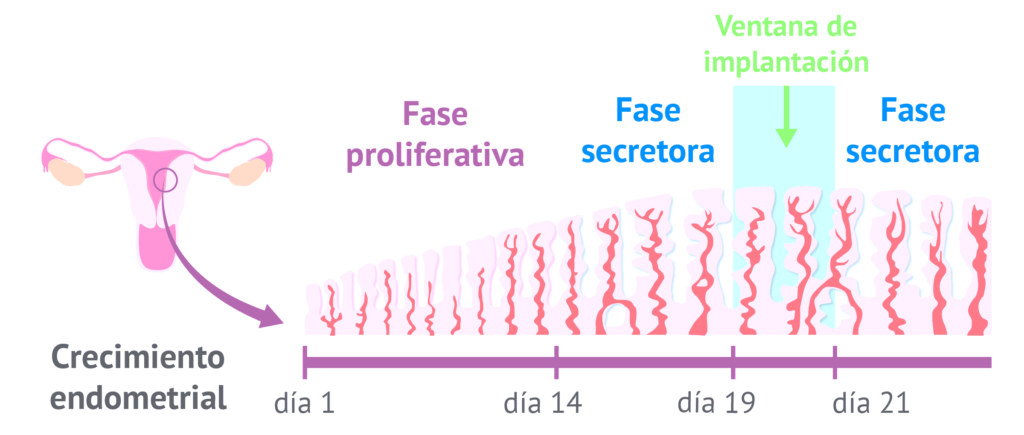
La implantación embrionaria es un fenómeno biológico único, mediante el cual el embrión, en estado de blastocisto, se adhiere e invade el endometrio materno para formar la placenta, que proporcionará una interfase entre el feto en crecimiento y la circulación materna. Este proceso ocurre durante la fase secretora del ciclo menstrual, en un periodo concreto de tiempo denominado ventana de implantación, donde la receptividad endometrial es óptima. Este estado de receptividad óptima tiene lugar entre los días 20 y 21 del ciclo, siete días después del pico de LH. El embrión es capaz de adherirse al endometrio únicamente durante este corto periodo de tiempo, por lo que el éxito de la implantación depende tanto de la calidad del embrión como de la receptividad del endometrio, afectando la variabilidad en cualquiera de estos dos factores a la correcta consecución del embarazo.
Numerosos estudios han demostrado que la incapacidad del endometrio para establecer un fenotipo receptivo es una causa muy común de infertilidad idiopática, incluso cuando se utilizan técnicas de reproducción asistida donde los embriones seleccionados son de alta calidad. Por todo ello, contar con una herramienta que permita identificar cuándo se encuentra abierta la ventana de implantación en una mujer, supone una estrategia esencial para aumentar las posibilidades de conseguir un embarazo exitoso.
Metodología
Gracias a la extracción de ARN procedente de una biopsia endometrial, y mediante el empleo de la tecnología de PCR a tiempo real, esta herramienta es capaz de analizar el perfil de expresión génica de 48 genes vinculados con aspectos como la receptividad endometrial y la respuesta inmunológica para detectar de manera precisa cuál es el estado de receptividad de la muestra analizada. En la mayoría de los casos, el momento de mayor receptividad del tejido endometrial ocurre 5 días y medio (P+5.5) después de la primera toma de progesterona en un ciclo sustituido, por lo que se recomienda tomar la biopsia en esta fecha.
Interpretación de los resultados
El análisis del perfil de expresión génica endometrial devolverá 3 posibles resultados:
-
Endometrio receptivo: se corresponde con un endometrio que ha alcanzado la ventana de implantación, por lo que se recomienda realizar la transferencia embrionaria en un ciclo de similares características al desarrollado para la toma de la biopsia endometrial.
-
Endometrio pre-receptivo: se corresponde con un endometrio que aún no ha alcanzado la ventana de implantación, por lo que se recomienda una segunda toma de biopsia o transferencia personalizada realizada con 24 horas más de impregnación con progesterona en un ciclo de similares características al desarrollado en el ciclo evaluado.
-
Endometrio post-receptivo: se corresponde con un endometrio que ha cerrado la ventana de implantación, por lo que se recomienda una segunda toma de biopsia o transferencia personalizada realizada con 24 horas más de impregnación con progesterona en un ciclo de similares características al desarrollado en el ciclo evaluado.
ENDOMIC 3. ESTUDIO DE FACTORES INMUNOLÓGICOS ENDOMETRIALES Y SISTÉMICOS
Fundamentos del estudio
A pesar de que la infertilidad se considera un desorden reproductivo de carácter multifactorial, actualmente, gran parte de los problemas reproductivos que se presentan en las consultas ginecológicas se deben a un desequilibrio a nivel inmunológico. El sistema inmune es un factor clave en la consecución y el mantenimiento del embarazo, por lo que cualquier alteración en el estado inmunológico puede conducir a problemas de infertilidad de diversa índole en distintas etapas del embarazo, como fallos de implantación o abortos de repetición.
En este contexto inmunológico cobra gran relevancia el endometrio, siendo uno de los tejidos maternos más importantes durante el proceso reproductivo. Para que el embarazo se produzca y se lleve a término de manera correcta, es necesario que el endometrio sufra numerosos cambios, tanto a nivel morfológico como en su composición celular. En este último aspecto, es de gran importancia el cambio que experimenta este tejido en la composición de sus células inmunológicas para, en primer lugar, permitir la correcta implantación del embrión en el útero materno, y posteriormente, asegurar el correcto desarrollo y crecimiento del feto.
Durante la ventana de implantación embrionaria, existe en el endometrio un flujo constante de células inmunes, donde el 70% está formado por células Natural Killer (NK), un 20% por macrófagos y células dendríticas, y un 10% por linfocitos T, siendo los linfocitos B más minoritarios. El tipo celular más abundante durante el proceso de implantación es el formado por las células NK, siendo denominadas células NK uterinas o deciduales (dNK). Durante la preparación del endometrio a lo largo del ciclo menstrual, las células NK deciduales viran su función a fin de preparar el tejido para una probable implantación. En lugar de actuar como citotóxicas y proinflamatorias, las células dNK contribuyen a la construcción y remodelación de tejido y formación de nuevos vasos con el objeto de revascularizar el endometrio, creando un ambiente adecuado en el endometrio para el logro de un embarazo exitoso.

Debido al importante papel que las células inmunológicas juegan durante el embarazo, cualquier desbalance en estas subpoblaciones celulares puede llevar a numerosos problemas reproductivos, siendo cada vez más los estudios que relacionan los cambios en los niveles de estas células con casos de infertilidad idiopática, fallos de implantación embrionaria, abortos recurrentes y otras patologías durante el embarazo. Por todo ello, estudiar el estado inmunológico de la mujer, es una herramienta indispensable para averiguar si sus problemas de infertilidad se deben a alguna alteración en su sistema inmune que esté impidiendo la consecución y el correcto desarrollo del embarazo, y en ese caso, ayudar a corregirla.
Metodología
Para realizar este estudio, es necesario contar con una muestra de sangre y una biopsia endometrial, en las que, mediante citometría de flujo, se realizará la inmunofenotipificación de distintas poblaciones celulares utilizando un panel de anticuerpos monoclonales conjugados en forma directa con diversos flurocromos.
Interpretación de los resultados
Tras la inmunofenotipificación de los distintos tipos celulares mencionados anteriormente, se proporcionará a la paciente un resultado detallado del recuento de cada una de estas poblaciones celulares inmunológicas, así como de la presencia de autoanticuerpos que puedan estar provocando algún desorden de carácter autoinmune, informando de si existe algún desequilibrio a este nivel que cree un ambiente inmunológico desfavorable para la correcta implantación del embrión y por tanto, la consecución del embarazo.
ENDOMIC 5. ESTUDIO DE FACTORES NUTRIGENETICOS ASOCIADOS A FERTILIDAD
Fundamentos del estudio
Uno de los principales factores ambientales que modifican e influyen sobre nuestros genes es la nutrición. La nutrigenética estudia la relación entre los genes y la alimentación, con el objetivo de conseguir un estado óptimo de salud a través de la dieta. La nutrición y el estilo de vida son factores desencadenantes de problemas en la fertilidad. Así, estudios en el campo de la epigenética concluyen que bebés de padres obesos pueden heredar la predisposición a tener sobrepeso, así como la tendencia a padecer enfermedades y desórdenes metabólicos.
No solo es importante ese efecto ambiental en la genética del bebé, sino que también la calidad de los gametos se ve afectada, como se observa en casos en los que un consumo excesivo de productos grasos provoca un efecto negativo en la cantidad y la movilidad del esperma. El sobrepeso en la mujer también supone un riesgo, ya que dificulta el embarazo debido a que el tejido adiposo tiene una función endocrina que interfiere negativamente en ciertos procesos del organismo provocando una inflamación crónica que afecta a la coagulación y al sistema cardiovascular, indispensable en el útero de la mujer para el desarrollo del embrión.
Por todo ello, llevar una dieta adecuada se convierte en un factor clave para lograr un embarazo con éxito, por lo que las recomendaciones nutricionales son esenciales tanto para parejas que busquen concebir de manera natural como para aquellas que se sometan a tratamientos de fertilidad.

Metodología
Este análisis nutrigenético permite estudiar las variantes genéticas de cada paciente con el fin de determinar qué plan nutricional es el más apropiado para conseguir un estado de fertilidad óptimo. Las variantes que incluye el estudio se han asociado con requerimientos nutricionales específicos y sensibilidad a ciertos componentes de la dieta.
En esta prueba genética, se analiza el ADN extraído de muestras de sangre o saliva, con el fin de estudiar la variación genética individual en 107 variantes genéticas de 75 loci mediante genotipificación. Esta genotipificación se realiza utilizando un Microchip de ADN en una plataforma que permite el análisis genético óptimo mediante la combinación de las ventajas de una química exacta de los cebadores de extensión con la espectrometría de masas MALDI-TOF. Las diferentes masas de cada uno de los productos de PCR generados se convierte en información del genotipo, proporcionando un alto rendimiento de muestras y un análisis de alta precisión.
Interpretación de los resultados
Tras el resultado de la genotipificación, se elaborará un plan de acción de acuerdo con las variantes detectadas, estableciendo una pauta nutricional personalizada para cada paciente que consiga mejorar sus problemas de fertilidad y en consecuencia, aumentar las posibilidades de conseguir un embarazo.
-
Insuficiencia ovarica primaria
INSUFICIENCIA OVÁRICA
¿Qué es la insuficiencia ovárica?
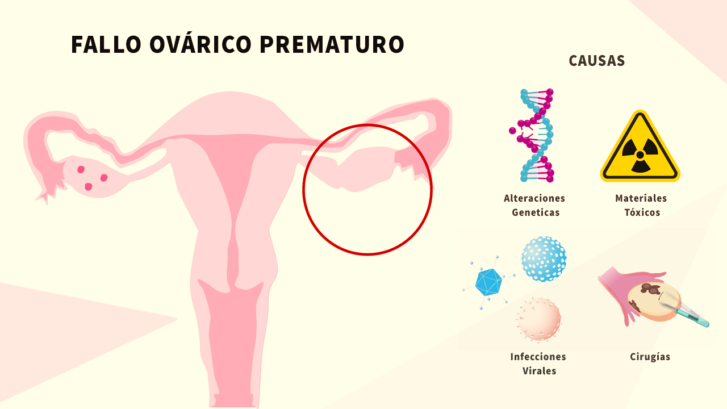
La insuficiencia ovárica primaria (IOP), también conocida como falla ovárica prematura, ocurre cuando los ovarios de una mujer dejan de funcionar en forma normal antes de cumplir los 40 años. Normalmente, los ovarios producen estrógenos y liberan un óvulo maduro en cada ciclo menstrual. La IOP hace que los ovarios no produzcan cantidades normales de estrógenos, y que no produzcan ni liberen un óvulo cada mes.
Alrededor de los 40 años, las mujeres son menos fértiles, pudiendo comenzar a tener períodos menstruales irregulares a medida que entran a la menopausia. No obstante, la insuficiencia ovárica primaria es diferente a la menopausia prematura. En la menopausia prematura, los períodos menstruales se detienen antes de los 40 años y la mujer ya no puede quedar embarazada. La causa puede ser natural o puede ser una enfermedad, cirugía, quimioterapia o radiación. Por el contrario, en la insuficiencia ovárica primaria, algunas mujeres todavía tienen períodos ocasionales, incluso pueden quedar embarazadas.
¿Cuáles son los síntomas y causas?
Los síntomas más comunes de la IOP son la irregularidad o suspensión de la menstruación, especialmente si la mujer también tiene calores repentinos. La menstruación puede ocurrir en forma intermitente o puede volver a comenzar muchos años después de que se diagnostique la insuficiencia ovárica. Debido a la disminución del nivel de estrógeno, las mujeres con IOP también pueden tener síntomas similares a los de la menopausia como sudores nocturnos, sequedad vaginal, irritabilidad, depresión, ansiedad, o dificultad para dormir o concentrarse.
En la mayoría de los casos se desconoce la causa de la insuficiencia ovárica primaria. Algunas mujeres con ciertos cambios en los genes y enfermedades genéticas, tales como el síndrome de Turner y el síndrome del cromosoma X Frágil, tienen mayores probabilidades de sufrir IOP. Además, la exposición a toxinas (por ejemplo, por quimioterapia y radiación) puede afectar la materia genética en las células y producir una insuficiencia ovárica primaria. A veces, una enfermedad autoinmune, cuando el sistema inmunitario ataca el propio tejido ovárico, puede ser responsable de la IOP.
¿Qué ofrecemos?
Desde OmicasLab, ofrecemos un panel compuesto por 25 genes implicados en el desarrollo de insuficiencia ovárica primaria (17 genes con relevancia clínica asociada y 8 genes emergentes), haciendo posible detectar si una paciente posee predisposición genética a desarrollar esta enfermedad. Para la realización de este estudio es necesario una muestra de sangre de la paciente, cuyo ADN será extraído y procesado posteriormente utilizando secuenciacion de nueva generación. De esta manera, se informará a la paciente de la presencia o ausencia de variantes genéticas asociadas al desarrollo de IOP.
-
Síndrome de ovario poliquístico
¿Qué es el Síndrome de Ovario Poliquístico?
El síndrome de ovario poliquístico (SOP) es un trastorno heterogéneo y multifactorial caracterizado por niveles elevados de andrógenos, irregularidades menstruales y/o quistes en uno o ambos ovarios. Este trastorno puede ser morfológico (ovarios poliquísticos) o predominantemente bioquímico (hiperandrogenemia). El hiperandrogenismo, un sello clínico de SOP, puede causar inhibición del desarrollo folicular, quistes en los ovarios, anovulación y cambios menstruales.
Se sabe que entre el 5% y el 10% de las mujeres de 18 a 44 años de edad se ven afectadas por el SOP lo que la convierte en la anomalía endocrina más común entre las mujeres en edad reproductiva. Las mujeres que buscan ayuda de profesionales de la salud para resolver problemas de obesidad, el acné, la amenorrea, el crecimiento excesivo del cabello y la infertilidad a menudo reciben un diagnóstico de SOP. Estas mujeres tienen tasas más altas de cáncer de endometrio, enfermedad cardiovascular, dislipidemia y diabetes mellitus tipo 2.
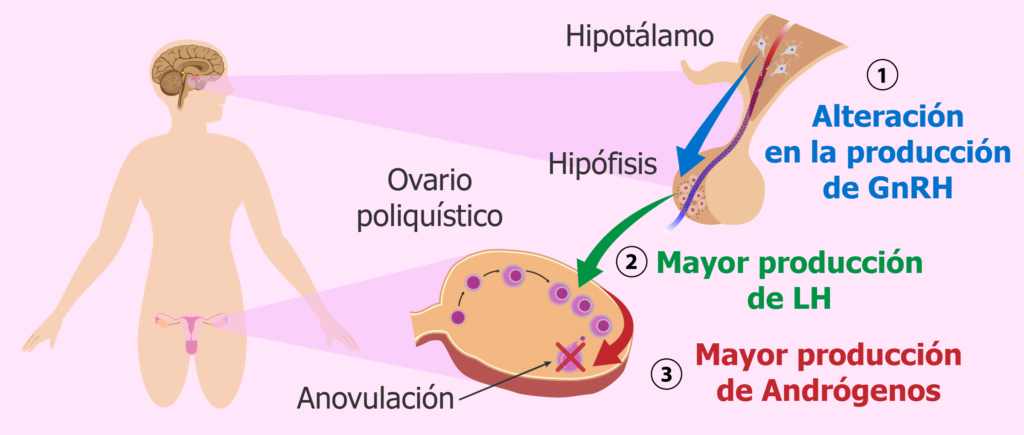
¿Cuáles son las causas?
Aunque la fisiopatología del SOP es desconocida, se ha sugerido que intervienen tanto factores genético como ambientales , provocando alteraciones en la liberación de hormona liberadora de gonadotropinas (Gn-RH), disregulación de la esteroidogénesis, aumento de los andrógenos e hiperinsulinemia. Múltiples genes han sido involucrados en la etiología del SOP: Genes relacio‐ nados con la esteroidogenesis CTP11a, CYP17, CYP21) o la acción de las hormonas esteroideas, genes que regulan la acción de las gonadotropinas, o la secreción de insulina o el metabolismo del tejido adiposo. También se han descrito múltiples polimorfismos que influirán en las alteraciones hormonales y en la clínica de las pacientes con SOP. Probablemente la variabilidad fenotípìca del SOP se deba a la distinta expresión de las diferentes alteraciones génicas que aparecen en las pacientes con esta patología.
¿Qué ofrecemos?
Desde OMICASLAB, ofrecemos un panel compuesto por 30 genes implicados el desarrollo de síndrome de ovario poliquístico, haciendo posible detectar si una paciente posee predisposición genética a desarrollar esta enfermedad. Para la realización de este estudio es necesario una muestra de sangre de la paciente, cuyo ADN será extraído y procesado posteriormente utilizando secuenciacion de nueva generación. De esta manera, se informará a la paciente de la presencia o ausencia de variantes genéticas asociadas al desarrollo de SOP.
-
Aborto recurrente
ABORTOS RECURRENTES ASOCIADOS A TROMBOFILIA
¿Qué son las trombofilias y cómo afectan al embarazo?
La trombofilia es la predisposición a desarrollar trombosis o coágulos venosos o arteriales, debido a anormalidades en el sistema de coagulación. Es el principal factor responsable del infarto agudo de miocardio, los accidentes cerebrovasculares y el tromboembolismo venoso, siendo además una de las causas más importantes de pérdida fetal. De hecho, cerca del 30% de las complicaciones obstétricas, como son los abortos de repetición y la infertilidad, son debidas a una trombofilia hereditaria. Las trombofilias hereditarias tienen una prevalencia del 10% en la población mundial, de las cuales, el 40% son de origen genético, ascendiendo el riesgo al 70% en individuos con antecedentes familiares, trombosis de repetición o de aparición temprana.
Las trombofilias se pueden asociar con mayor riesgo de complicaciones gestacionales como aborto temprano recurrente de menos de 10 semanas de gestación, muerte fetal intrauterina, parto prematuro, restricción de crecimiento intrauterino, desprendimiento prematuro de placenta y preeclampsia.
Durante el embarazo se producen cambios hemoestáticos en la mujer, se alteran algunos factores sanguíneos, se produce un incremento de los factores de coagulación FI, FVII, FVIII, FIX y FX, disminuye la concentración de la proteína S y se producen otras reacciones en cadena que finalmente generan trombina. Esta proteína puede actuar causando pérdida gestacional de dos maneras posibles: por un lado, desencadenando una respuesta inflamatoria a través de la liberación de citoquinas, implicando también al sistema inmune y provocando una pérdida temprana. Por otro lado, la trombina puede actuar produciendo
pequeños trombos en los vasos que irrigan la placenta, causando insuficiencia placentaria que está relacionada con abortos a partir de la semana 10 de gestación.
Teniendo en cuenta el papel que pueden jugar las trombofilias y otros desórdenes hemoestáticos en la pérdida del embarazo, se hace esencial contar con una herramienta que pueda identificar el riesgo genético de una mujer de padecer este tipo de trastornos, y a su vez, averiguar si estos trastornos son la causa subyacente de sus problemas reproductivos.
¿Qué ofrecemos?
Desde Omicaslab ofrecemos un estudio genético que analiza genes y variantes genéticas implicadas en la deficiencia de inhibidores naturales de la coagulación y en la síntesis de factores de coagulación con el fin de averiguar si existe un riesgo genético que predisponga a la paciente a sufrir trombofilia.
¿Cómo se lleva a cabo el estudio?
Para realizar el test se requiere una muestra de sangre o saliva de la paciente. Una vez que la muestra ha sido tomada, se analizan 11 genes (15 variantes genéticas) marcadores implicados en trombofilias:
-
FII, FV, FXII, F13A, FGB, GP1BA, MTHFR, PAI1, PROCR, PROS1, SERPNIC
Indicaciones del estudio
Este test se centra en el estudio de variantes genéticas específicas que constituyen un factor de riesgo genético indicado exclusivamente para:
-
Antecedentes personales de eventos tromboembólicos, accidente cerebrovascular, infarto de miocardio a una edad temprana.
-
Sin antecedentes de ETV (enfermedad tromboembólica venosa) pero expuestos a factores de riesgo como lo son: largos viajes, cirugías mayores u ortopédicas, las lesiones musculares y de los vasos, el embarazo, las enfermedades crónicas o la edad, fumadores u obesas.
-
Mujeres con 2 o más abortos, retraso en el crecimiento o muerte fetal intraútero, desprendimiento de placenta, baja tasa de implantación o preeclampsia.
ESTUDIO DE DNA FETAL EN SANGRE MATERNA EN EMBARAZO DETENIDO
¿Qué importancia tienen las alteraciones genéticas y cromosómicas en la pérdida del embarazo?
El aborto espontáneo es la complicación más frecuente del embarazo temprano. Se estima que entre un 10-15% de los embarazos terminan en un aborto espontáneo, principalmente durante las 13 primeras semanas del embarazo. Estas pérdidas gestacionales se deben normalmente a factores fetales y maternos, sin embargo, en un 50% de los casos, los abortos que se producen durante el primer trimestre de gestación son originados por alteraciones genéticas y anomalías cromosómicas en el embrión. De este porcentaje, las alteraciones numéricas (trisomías, monosomías, poliploidías, etc) están involucradas en un 96% de los casos. Por ello, analizando anomalías cromosómicas en casos de abortos espontáneos, es posible identificar la causa de la detención del embarazo en un porcentaje superior al 90%.
¿Qué ofrecemos?
Desde OmicasLab, ofrecemos una prueba que proporciona respuestas sobre la posible causa de pérdida del embarazo, detectando si fue debida a la presencia de anomalías cromosómicas en el feto. Se trata de un ensayo de screening no invasivo en plasma materno que detecta aneuploidías cromosómicas y CNVs en el feto, cuando la gesta se ha detenido espontáneamente, con el fin de identificar una causa cromosómica responsable. Esta prueba resulta útil en la detección no invasiva de aneuploidías a partir de las 7 semanas de gestación y dentro de las 2-3 semanas de detenido el embarazo en forma espontánea. Para ello, gracias al empleo de secuenciacion de nueva generación, analiza los fragmentos de ADN fetal que fueron liberados del trofoblasto placentario, y que aún circulan libremente en la sangre materna, siendo posible identificar si existían anomalías cromosómicas que provocaran la pérdida del embarazo.
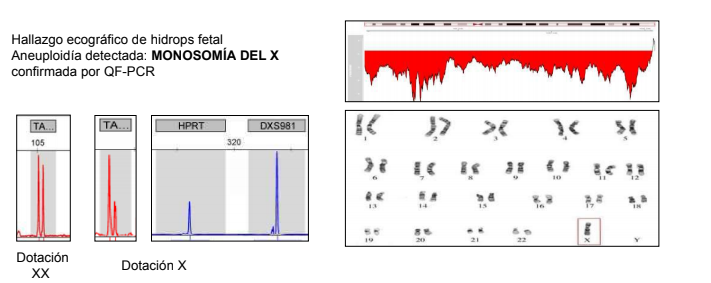
Entre las anomalías más prevalentes que esta prueba es capaz de detectar se encuentran, entre otras:
Trisomías
-
Trisomía 21 (Síndrome de Down)
-
Trisomía 18 (Síndrome de Edwards)
-
Trisomía 13 (Síndrome de Patau)
-
Trisomía 7, 9, 14, 15, 16, 22: son las trisomías más frecuentes causantes de la perdida de embarazo. Estas trisomías pueden afectar a todas las células del organismo, en cuyo caso se denomina trisomía pura, o ser un mosaicismo en el que algunas células presentan la dotación cromosómica normal y otras no. El 92% de los fetos con estas trisomías puras fallecen entre los 4 y 9 meses del embarazo, produciéndose un aborto espontáneo
Aneuploidías cromosómicas sexuales
- Síndrome de Turner (45, X0)
- Síndrome de Klinefelter (47, XXY)
- Trisomía del cromosoma X (47, XXX)
- Síndrome de Jacobs o Disomía del Y (47, XYY)
Características del test y aplicaciones
-
Para detección no invasiva de aneuploidías en gesta detenida en forma espontánea
-
Especialmente útil en pacientes con abortos recurrentes
-
Indicada a partir de las 7 semanas de gestación y durante todo el embarazo
-
A realizar dentro de las 2-3 semanas de detenido el embarazo en forma espontánea
-
Identifica aneuploidías en todos los cromosomas
-
Determina el sexo fetal
-
Detecta variante en número de copias (CNV) patogénicas
-
Útil en embarazos únicos, gemelares, ovodonación y FIV
-
-
Endometriosis y adenomiosis
ENDOMETRIOSIS
¿Qué es la endometriosis?
La endometriosis es una enfermedad crónica benigna que afecta del 5 al 10% de la población en edad reproductiva entre los 15 a 45 años. El rasgo que define esta patología es la presencia de tejido endometrial en sitios fuera de la cavidad uterina, principalmente en el peritoneo pélvico y los ovarios, con capacidad para crecer e invadir otras estructuras. Los síntomas de la endometriosis son diversos, en ocasiones con una importante afectación de la calidad de vida, aunque algunas mujeres con la enfermedad podrían no tener síntomas o confundirlos con los de otras patologías. Por lo tanto, el diagnóstico de la endometriosis basado únicamente en síntomas es difícil, dando lugar a que se tarde en promedio entre 8 y 10 años para poder diagnosticarla. Además, debido a la gran variedad sintomática y a la conciencia generalizada por parte de las mujeres de que es normal que la menstruación duela, puede pasar mucho tiempo hasta que la paciente es diagnosticada.
En general los síntomas de la endometriosis son más intensos durante el periodo menstrual. Las pacientes suelen presentar cólicos, dolor abdominal o de espalda, dolor durante y después de las relaciones sexuales, dolor al orinar o defecar, hemorragias y problemas de esterilidad, estimándose que un 30-40% de las mujeres que padecen endometriosis tienen problemas de infertilidad.
En cuanto a la etiología de la enfermedad, es muy variada y aún se desconoce. Se sabe que el desarrollo de la endometriosis tiene un importante componente genético, epigenético, de hormono-dependencia e inflamatorio; por lo que debe ser considerada como una enfermedad crónica, que requiere un plan de tratamiento a lo largo de la vida, maximizando el uso de tratamiento médico y evitando la repetición de tratamientos quirúrgicos.
Las técnicas estándar para el diagnóstico de la endometriosis o para la determinación de su estadío se realizan mediante la visualización quirúrgica y posterior confirmación histológica, para lo cual es necesario utilizar anestesia general, con los consecuentes riesgos, costes y posibles efectos secundarios. Cuando se sospecha de endometriosis, el dolor se trata empíricamente con esteroides anticonceptivos y medicamentos antiinflamatorios, pero estas terapias no son satisfactorias en el 20% de las mujeres debido a los efectos secundarios o la resistencia. Por lo tanto, se necesitan otras herramientas que permitan detectar de manera precoz la predisposición a padecer este trastorno para acortar el tiempo hasta el diagnóstico, minimizar la progresión de la enfermedad y el riesgo de complicaciones, optimizar el tiempo, y monitorear la recurrencia de la enfermedad.
¿Qué ofrecemos?
Desde OmicasLab ofrecemos una herramienta sencilla y eficaz para el monitoreo y seguimiento de la endometriosis mediante el empleo de un panel de expresión génica compuesto por 192 genes vinculados a aspectos cruciales en el desarrollo de esta patología, como son los procesos inflamatorios o la respuesta inmunológica.
¿Cómo se lleva a cabo el estudio?
Para la realización de este estudio únicamente es necesario contar con una muestra de tejido endometrial. Tras el procesamiento de la muestra, y mediante tecnología de qPCR a tiempo real, es posible analizar el patrón de expresión génica del endometrio que nos permite identificar en qué estadio se encuentra la enfermedad, monitorear su desarrollo y diseñar posibles estrategias de tratamiento.
-
Enfermedades prevalentes e infertilidad
ENFERMEDADES PREVALENTES E INFERTILIDAD
¿Qué relación tienen la nutrigenética, las enfermedades prevalentes y la infertilidad?
Uno de los principales factores ambientales que modifican e influyen sobre nuestros genes es la nutrición. La nutrigenética estudia la relación entre los genes y la alimentación, con el objetivo de conseguir un estado óptimo de salud a través de la dieta.
La nutrición y el estilo de vida son factores desencadenantes de problemas en la fertilidad. Así, estudios en el campo de la epigenética concluyen que bebés de padres obesos pueden heredar la predisposición a tener sobrepeso, así como la tendencia a padecer enfermedades y desórdenes metabólicos. No solo es importante ese efecto ambiental en la genética del bebé, sino que también la calidad de los gametos se ve afectada, como se observa en casos en los que un consumo excesivo de productos grasos provoca un efecto negativo en la cantidad y la movilidad del esperma.
El sobrepeso en la mujer también supone un riesgo, ya que dificulta el embarazo debido a que el tejido adiposo tiene una función endocrina que interfiere negativamente en ciertos procesos del organismo provocando una inflamación crónica que afecta a la coagulación y al sistema cardiovascular, indispensable en el útero de la mujer para el desarrollo del embrión.
Por todo ello, llevar una dieta adecuada se convierte en un factor clave para lograr un embarazo con éxito, por lo que las recomendaciones nutricionales son esenciales tanto para parejas que busquen concebir de manera natural como para aquellas que se sometan a tratamientos de fertilidad.
¿Qué ofrecemos?
Desde OmicasLab, ofrecemos un análisis nutrigenético que permite estudiar las variantes genéticas de cada paciente con el fin de determinar qué plan nutricional es el más apropiado para conseguir un estado de fertilidad óptimo. Las variantes que incluye el estudio se han asociado con requerimientos nutricionales específicos y sensibilidad a ciertos componentes de la dieta.
¿Cómo se lleva a cabo el estudio?
En esta prueba genética, se analiza el ADN extraído de muestras de sangre o saliva, con el fin de estudiar la variación genética individual en 107 variantes genéticas de 75 loci mediante genotipificación. Esta genotipificación se realiza utilizando un Microchip de ADN en una plataforma que permite el análisis genético óptimo mediante la combinación de las ventajas de una química exacta de los cebadores de extensión con la espectrometría de masas MALDI-TOF. Las diferentes masas de cada uno de los productos de PCR generados se convierte en información del genotipo, proporcionando un alto rendimiento de muestras y un análisis de alta precisión.
Interpretación de los resultados
Tras el resultado de la genotipificación, se elaborará un plan de acción de acuerdo con las variantes detectadas, estableciendo una pauta nutricional personalizada para cada paciente que consiga mejorar sus problemas de fertilidad y en consecuencia, aumentar las posibilidades de conseguir un embarazo.
PARA EL HOMBRE
-
Agenesia de conductos y azoospermia
AGENESIA DE CONDUCTOS Y AZOOSPERMIA
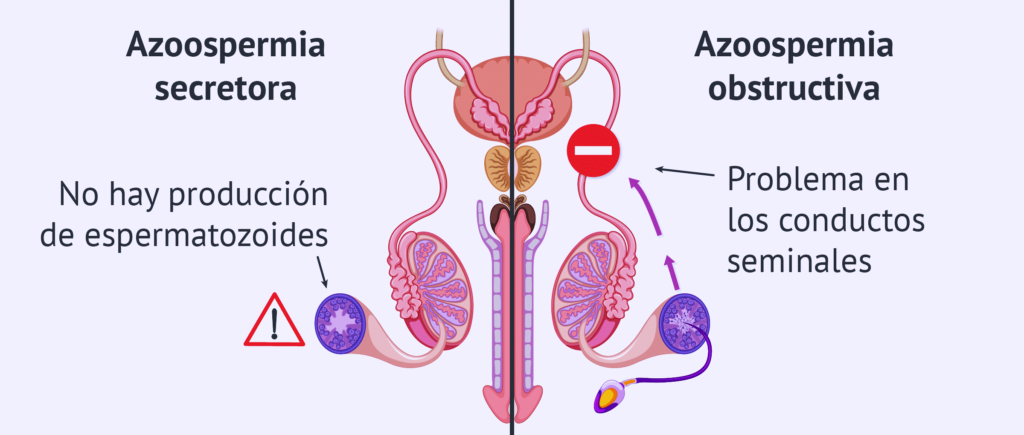
¿Qué es la azoospermia?
La azoospermia es la ausencia de espermatozoides en el semen. Puede ser debida a una falta de producción de espermatozoides por parte de los testículos (azoospermia secretora) o bien a una obstrucción de los largos conductos por los que transcurren los espermatozoides hasta ser expulsados en la uretra durante la eyaculación (azoospermia excretora u obstructiva).
¿Cuál es su causa?
Cuando el testículo no produce espermatozoides puede ser debido a alteraciones genéticas, por lo que deberá realizarse un cariotipo y un estudio específico del cromosoma Y que es donde se hallan determinados genes que determinan la producción de espermatozoides. En cambio, La azoospermia obstructiva puede diagnosticarse durante la exploración física del paciente en aquellos casos en los que, por una malformación congénita, no se han desarrollado los conductos deferentes. En casi el 100% de los casos esta anomalía se asocia a mutaciones del gen de la fibrosis quística, por lo que deberá realizarse un estudio genético en todos los pacientes que deseen proceder a la inyección espermática intracitoplasmática, dado que presentan un número normal de espermatozoides a nivel del testículo. Si se detectan mutaciones del gen (CFTR), debe realizarse el mismo estudio a la pareja. Si ambos son portadores del gen de la fibrosis quística debe aconsejarse el estudio genético preimplantacional de los embriones obtenidos en el proceso de la ICSI con el fin de transferir al útero los que no presentan el mismo problema que los padres.
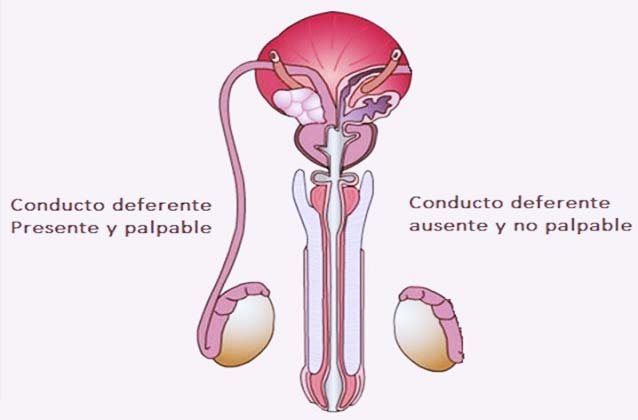
¿Qué es la agenesia de conductos?
La ausencia bilateral congénita del conducto deferente (CBAVD) es una causa frecuente de azoospermia obstructiva, que representa aproximadamente el 2% de los casos de infertilidad masculina. La CBAVD puede ocurrir solo o como un signo de la fibrosis quística. Aunque muchos varones con ausencia bilateral congénita de los conductos deferentes no tienen los otros rasgos característicos de la fibrosis quística, algunos afectados pueden presentar problemas digestivos o respiratorios leves.
¿Cuál es su causa?
La CBAVD es debida en más de la mitad de los casos a mutaciones en el gen CFTR. En los casos de ausencia bilateral congénita de los conductos deferentes sin una mutación en el gen CFTR, se desconoce el motivo de esta alteración. Algunos casos están asociados con otras anomalías estructurales de las vías urinarias.
Se han identificado al menos 80 mutaciones en el gen CFTR en los varones con ausencia bilateral congénita de los conductos deferentes. Estas mutaciones interrumpen la función del canal de cloruro, impidiendo el flujo normal de los iones de cloruro y agua en el interior y exterior de las células. Como consecuencia, las células del tracto genital masculino producen una mucosidad anormalmente espesa y pegajosa. Esta mucosidad obstruye los conductos deferentes conforme se van desarrollando, haciendo que se deterioren antes del nacimiento. Sin el conducto deferente, los espermatozoides no pueden ser transportados desde los testículos para incluirse en el semen. Por lo tanto, los varones con ausencia bilateral congénita de los conductos deferentes son infértiles a menos que se utilicen técnicas de reproducción asistida.
¿Qué ofrecemos?
Desde OmicasLab, ofrecemos un panel compuesto por una serie de genes implicados en el desarrollo de agenesia de conductos y azoospermia, haciendo posible detectar si el paciente posee predisposición genética a desarrollar estos trastornos. Para la realización de este estudio es necesario una muestra de sangre del paciente, cuyo ADN será extraído y procesado posteriormente utilizando secuenciacion de nueva generación. De esta manera, se informará al paciente de la presencia o ausencia de variantes genéticas asociadas al desarrollo de agenesia de conductos y azoospermia.
FUENTE IMAGENES: https://www.reproduccionasistida.org/azoospermia/
-
Insensibilidad a andrógenos
SÍNDROME DE INSENSIBILIDAD A LOS ANDRÓGENOS
¿Qué es el síndrome de insensibilidad a los andrógenos?
El Síndrome de Insensibilidad Androgénica (SIA) es una enfermedad caracterizada por la resistencia de los tejidos diana a la acción de las hormonas masculinas, lo que impide el desarrollo masculino normal de los genitales internos y externos de los individuos genéticamente varones (46,XY). Este síndrome se refiere a una persona que es genéticamente masculina pero al mismo tiempo presenta una resistencia celular de alto grado a las hormonas masculinas (andrógenos), lo que trae como resultado que este sujeto tenga algunos o todos los rasgos físicos de una mujer, conservando los rasgos genéticos de un hombre.
¿Cómo se manifiesta?
El SIA se manifiesta clínicamente de forma variable, observándose desde varones fenotípicamente normales con alteraciones de la espermatogénesis hasta mujeres fenotípicamente normales con amenorrea primaria (ausencia de periodo menstrual), pasando por estados diversos de ambigüedad genital en el recién nacido. Como enfermedad rara, el Síndrome de insensibilidad androgénica (SIA) presenta una prevalencia que no supera los 5 casos por 10.000 habitantes. Se ha estimado un 1 caso de SIA completo por cada 20.000 a 64.000 recién nacidos varones. En cuanto al diagnóstico de este síndrome, se requiere el examen físico, hormonal y genético, lo más detallado y precoz posible, siendo imprescindible para la asignación del sexo y para la recomendación de tratamientos que prevengan sus complicaciones.
Se han descrito tres fenotipos del SIA:
• SIA completo (Síndrome de Morris)
• SIA parcial (Síndrome de Reinfenstein)
• SIA leve o mínimo (Síndrome del varón infértil)
¿Cuál es su origen?
El SIA es una enfermedad genética, de carácter recesivo ligada al cromosoma X, producida por diversas mutaciones del gen del receptor androgénico (AR). En la mayoría de los casos de síndromes de insensibilidad completa se han detectado mutaciones sin sentido (80%), deleciones parciales (7%), codones de terminación (7%), anomalías de corte y empalme (2%) y deleciones completas del gen AR (1%).
¿Qué ofrecemos?
Desde OmicasLab, ofrecemos un panel compuesto por una serie de genes implicados en el desarrollo de síndrome de insensibilidad a andrógenos, haciendo posible detectar si el paciente posee predisposición genética a desarrollar este trastorno. Para la realización de este estudio es necesario una muestra de sangre del paciente, cuyo ADN será extraído y procesado posteriormente utilizando secuenciacion de nueva generación. De esta manera, se informará al paciente de la presencia o ausencia de variantes genéticas asociadas al desarrollo de insensibilidad a andrógenos.
-
Hipogonadismo hipogonadotrófico
HIPOGONADISMO HIPOGONADOTRÓFICO
¿Qué es el hipogonadismo masculino?
El hipogonadismo masculino es la imposibilidad del testículo para producir cantidades normales de testosterona junto con la presencia de síntomas y signos de deficiencia androgénica (deficiencia de hormonas sexuales masculinas). El descenso significativo de la acción androgénica se asocia a un síndrome consistente en osteoporosis, debilidad, redistribución de la grasa corporal, anemia, descenso de la libido y de la función sexual, malestar y anomalías cognitivas. Se trata de una alteración caracterizada por una falta parcial o completa de desarrollo puberal o maduración sexual, debida a una alteración en la secreción de las gonadotrofinas pituitarias LH y FSH, como consecuencia de la deficiencia de GnRH (hormona liberadora de gonadotrofina).

¿Cuáles son las causas y síntomas?
El hipogonadismo masculino se evidencia cuando los testículos dejan de producir espermatozoides, testosterona o ambos. Existen tres mecanismos básicos:
-
Un daño testicular intrínseco (hipogonadismo primario).
-
Una anomalía del eje hipotálamo- hipófisis (hipogonadismo secundario).
-
Una respuesta disminuida o ausente de los órganos blanco (piel, vello y próstata) a los andrógenos (resistencia androgénica).
Algunos de los signos característicos del hipogonadismo hipogonadotrófico pueden incluir ausencia de características sexuales secundarias, como vello púbico, axilar y facial, falta de desarrollo en la pubertad con desarrollo incompleto o retraso significativo, testículos subdesarrollados y, en algunos casos, estatura baja. El HH puede sospecharse desde el nacimiento por la presencia de un micropene en los varones, normalmente asociado a una criptorquidia, por un retraso o ausencia total de la pubertad en la adolescencia o por infertilidad en la edad adulta. El HH es también un rasgo de diversos síndromes como el síndrome de Kallmann, el síndrome de Prader-Willi, el síndrome de Bradet-Biedl, el síndrome de Laurence-Moon y el síndrome CHARGE.
Se sabe que existen determinadas mutaciones en genes relacionados con el desarrollo de hipogonadismo hipogonadotrópico. Las mutaciones que alteran o inactivan al receptor de GnRH fueron las primeras alteraciones detectadas. Sin embargo, en los últimos años, se han identificado otras mutaciones que están íntimamente ligadas al desarrollo de este trastorno.
¿Qué ofrecemos?
Desde OmicasLab, ofrecemos un panel compuesto por una serie de genes implicados en el desarrollo de hipogonadismo hipogonadotrópico, haciendo posible detectar si el paciente posee predisposición genética a desarrollar esta enfermedad. Para la realización de este estudio es necesario una muestra de sangre del paciente, cuyo ADN será extraído y procesado posteriormente utilizando secuenciacion de nueva generación. De esta manera, se informará al paciente de la presencia o ausencia de variantes genéticas asociadas al desarrollo de hipogonadismo hopogonadotrópico.
-
-
Microdeleciones del cromosoma Y
MICRODELECIONES EN EL CROMOSOMA Y
¿Qué importancia tienen las microdeleciones en el cromosoma Y?
El cromosoma Y es el que diferencia los varones de las mujeres y contiene la información necesaria para la adecuada diferenciación sexual así como para la formación de espermatozoides. Se estima que el 10% de los varones con alteraciones en el espermograma pueden tener ausencia de ciertas regiones del cromosoma Y. Las microdeleciones del cromosoma Y pueden ser responsables del 15% de las causas de azoospermias (falta de producción de espermatozoides) no obstructivas y del 6% de las oligozoospermias severas (baja cantidad de espermatozoides en el semen).
Mediante el estudio de microdeleciones del cromosoma Y se comprueba si el cromosoma Y está íntegro o presenta alguna pérdida de información, estableciendo cuál es la causa del bajo recuento espermático. Además, al identificarse la pérdida de alguna región, debe informarse mediante un adecuado consejo genético de todas las implicaciones genéticas que tenga, ya que dicha alteración se encuentra en un cromosoma y se transmitirá a todos los varones de la siguiente generación.
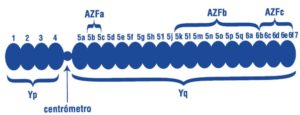
En el cromosoma Y se han identificado ciertas regiones llamadas AZFa, AZFb y AZFc que están implicadas en la producción de espermatozoides. Se ha observado que en pacientes con un bajo número de espermatozoides o ausencia total tienen pérdidas de alguna o varias de estas regiones. En el caso de detectarse una microdeleción del cromosoma Y es importante además conocer cuál es la región delecionada (AZFa, AZFb o AZfc) o si hay una combinación de ambas. La identificación de la región delecionada tiene un interés importante ya que existe diferente grado de severidad sobre la producción de espermatozoides. Además, esto será clave en el caso de pacientes azoospermicos (ausencia de espermatozoides en el eyaculado), ya que es importante saber cuál es la probabilidad de encontrar espermatozoides en el testículo y por tanto la posibilidad de descendencia biológica.
¿Qué ofrecemos?
Desde OMICASLAB, ofrecemos un estudio completo de las regiones AZFa, AZFb y AZFc para detectar si existe alguna microdeleción en el cromosoma Y. Para realizar este estudio se debe obtener ADN del individuo. Para ello, se puede realizar un análisis de sangre o bien una toma de saliva. A partir de cualquiera de estos dos tipos de muestra biológica se realiza la extracción de ADN. Mediante la técnica de PCR (Reacción en cadena de la polimerasa) se detectarán las regiones AZFa, AZFb y AZFc. La presencia de todas las regiones indica que el paciente no tiene ninguna alteración. La ausencia de alguna región implica que el paciente es portador de microdeleciones en el cromosoma Y.
